- Entspricht Radius der Elektronenbahn im
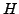 -Atom (Wasserstoff)
-Atom (Wasserstoff)
Hat genau ein Elektron, und beliebig viele Protonen.
Auf der ![]() -Achse werden die verschiedenen Energien in Abhängigkeit
von
-Achse werden die verschiedenen Energien in Abhängigkeit
von ![]() aufgetragen. Um ein Elektron zu befreien (das Atom zu Ionisieren)
muss ihm genügend Energie zugeführt werden, um es über die
aufgetragen. Um ein Elektron zu befreien (das Atom zu Ionisieren)
muss ihm genügend Energie zugeführt werden, um es über die ![]() -Achse
zu befördern. Die überschüssige Energie ist dann als Impuls vorhanden.
Um ein Elektron von einer Orbitale zu einer Anderen zu bringen (Änderung
des
-Achse
zu befördern. Die überschüssige Energie ist dann als Impuls vorhanden.
Um ein Elektron von einer Orbitale zu einer Anderen zu bringen (Änderung
des ![]() 's), muss ihm genau diese Energiemenge zugeführt werden,
bzw. es gibt dies in Form eines Photonenquants (Licht) ab.
's), muss ihm genau diese Energiemenge zugeführt werden,
bzw. es gibt dies in Form eines Photonenquants (Licht) ab.