




Next: Mikroskopische Analyse des Gasdrucks
Up: Wärmelehre
Previous: Empirische Gasgesetze
Contents
Index
- Mol
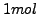 ist diejenige Substanzmenge,
die die gleiche Anzahl von Teilchen (Atomen, Molekülen, Ionen, Elektronen)
enthält wie
ist diejenige Substanzmenge,
die die gleiche Anzahl von Teilchen (Atomen, Molekülen, Ionen, Elektronen)
enthält wie
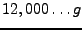 von
von 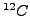 .
.
- Stoffmenge
-
![$ \left[\nu\right]=1mol$](img85.png)
- Avogadro'sche Zahl
-
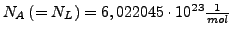
- Anzahl von Teilchen pro Mol
- Auch Loschmidt'sche Zahl genannt
- Anzahl der Molekühle
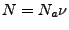
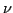 Anzahl der Mole
Anzahl der Mole
- Molmasse
-
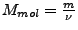
- Molvolumen
-
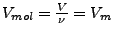
- Normalvolumen
-
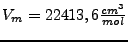
- Unter Normalbedingungen haben alle üblichen Gase ein Volumen von
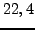 l
pro
l
pro 
- Moldichte
-
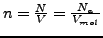
- allgemeine Gaskonstante
-
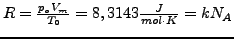
- Zustandsgleichung
-
- ideales Gas
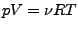
- reelles Gas
-
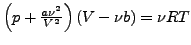
Marco Möller 16:43:44 24.10.2005