Hierbei werden die Eigenvolumina in
![]() und die Wechselwirkungskräfte
der Teilchen
und die Wechselwirkungskräfte
der Teilchen
![]() .
.
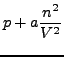 |
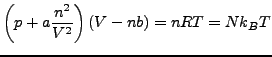
Die Van der Waalsgleichung lässt sich auch wie folgt umformen:
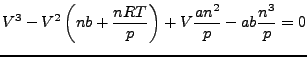
Diese gleichung hat für ![]() nur eine reelle Lösung.
nur eine reelle Lösung.
Das Tripel
![]() nennt sich Kritischer
Punkt. Es gilt:
nennt sich Kritischer
Punkt. Es gilt:
durch Koeffizientenvegleich erhält man:
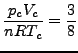 |
für reale Gase ist
![]() . Beim idealen Gas ist
. Beim idealen Gas ist ![]() .
.
Mit Hilfe reduzierter Größen lässt sich die Vanderwaals Gleichung
wie folgt umschreiben:
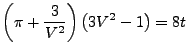
Im Bereich unterhalb von ![]() wird die Kurve ein Stückweit durch
eine Gerade parallel zu
wird die Kurve ein Stückweit durch
eine Gerade parallel zu ![]() Achse ersetzt, und zwar so, das die Fläche
zwischen den beiden Kurven im Bereich zwischen den Schnittpunkten
gleich 0 ist.
Achse ersetzt, und zwar so, das die Fläche
zwischen den beiden Kurven im Bereich zwischen den Schnittpunkten
gleich 0 ist.
Die Van der Waalsgleichung lässt sich auch schreiben als
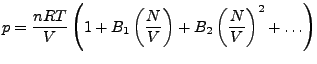
 |
|||
 |